
Analiza przesiewowa (screening) szczepienionki Synflorix nr serii ASPNB005AE
Omówienie wyników analizy
Analiza szczepionki Synflorix została przeprowadzona przy użyciu dwóch metod:
ANALIZA ZANIECZYSZCZEŃ I ZANIECZYSZCZEŃ CHEMICZNYCH I BIAŁEK
System analizy LC-SACI / ESI-MS wyposażony w innowacyjną platformę SANIST został wykorzystany zarówno do przeprowadzenia wstępnego badania przesiewowego wybranych szczepionek, jak i w celu potwierdzenia standardów kontroli, z minimalnym limitem różnicy między nanogramami i mikrogramami na dawkę.
Technologia SANIST
- zestaw do ekstrakcji analitów ( do ustalenia nieznanych substancji);
- System analizy LC-SACI / ESI-MS, który pozwala zmniejszyć hałas chemiczny spektrometrów masowych i uzyskać lepsze wykrywanie sygnałów instrumentalnych;
- System przetwarzania danych SANIST składa się z lokalnej i sieciowej platformy bioinformatycznej zdolnej do przetwarzania danych przy użyciu dedykowanych baz danych i niestandardowych algorytmów.
Ustalono, że w fazie przygotowań ustala się rozpoznawanie w dziedzinie badań naukowych i badań w oficjalnych bazach (KEGG, NCBI-Prot i SwissProt) bez stosowania certyfikowanych standardów analitycznych. Konieczne jest zatem przeprowadzenie analizy drugiego poziomu z certyfikowanymi standardami analitycznymi w celu potwierdzenia jej identyfikacji.

ANALIZA MATERIAŁU GENETYCZNEGO
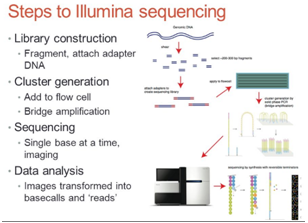
Test na obecność kwasów nukleinowych (DNA / RNA) pochodzenia ludzkiego i zwierzęcego oraz mikroorganizmów (wirusy, bakterie) przy użyciu metody sekwencjonowania nowej generacji (Next Generation Sequencing), która pozwoliła na ilościowe określenie sekwencji materiału genetycznego zawartego w szczepionkach zbadane w wysoce specyficzny i dokładny sposób .
Ponadto sekwencjonowanie nowej generacji ( Next Generation Sequencing), znane również jako głębokie sekwencjonowanie (deep sequencing), generuje pojedynczą sekwencję z każdego fragmentu DNA lub cDNA obecnego w pojedynczej próbce. Następnie analiza bioinformatyczna umożliwia rozróżnienie pochodzenia fragmentów sekwencji, na przykład ludzka, gatunków bakterii lub konkretnego wirusa. Oznacza to, że mieszane próbki biologiczne mogą być łatwo oddzielone za pomocą tej technologii, która obecnie weszła w rutynę badań genomicznych i diagnostyki.
Ponadto na podstawie danych NGS można zrekonstruować całą sekwencję wirusowych genomów DNA i RNA oraz genomów bakteryjnych obecnych w próbce i porównać je z genomami referencyjnymi obecnymi w publicznych bazach danych.
SYNFLORIX
PODSUMOWANIE CHARAKTERYSTYKI PRODUKTU LECZNICZEGO https://pl.gsk.com/media/718163/synflorix-druki-pl-ii-108-26_01_2017.pdf

6. INFORMACJE FARMACEUTYCZNE
6.1 Lista substancji pomocniczych
Pojemniki z jedną dawką i 2 dawkami
Chlorek Sodu , woda do wstrzykiwań
Pojemnik z 4 dawkami
Chlorek sodu,2-fenoksyetanol, woda do wstrzykiwań https://www.ema.europa.eu/en/documents/assessment-report/synflorix-epar-public-assessment-report_en.pdf
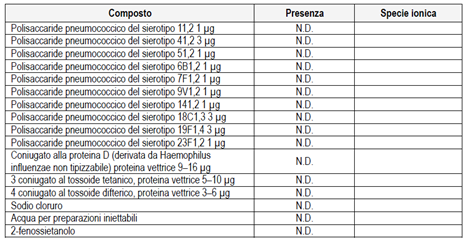
Synflorix składa się z otoczkowych polisacharydów oczyszczonych z 10 serotypów 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F i 23F, każdy połączony z białkiem nośnikowym lub białkiem D (PD), anatoksyną tężcową (TT lub T) lub anatoksyna błonicza (DT). Białko D jest stosowane jako białko wektorowe dla 8 z 10 serotypów (serotypy 1, 4, 5, 6B, 7F, 9V, 14 i 23F).Wszystkie polisacharydy połączone z PD formułuje się w dawce 1 ?g polisacharydu na dawkę (serotypy 1, 5, 6B, 7F, 9V, 14, 23F), z wyjątkiem serotypu 4 w dawce 3 ?g.Serotyp 19F skoniugowany z DT i serotyp 18C skoniugowany z TT są formułowane przy 3 ?g polisacharydu.Synflorix jest płynną zawiesiną bez konserwantów, adiuwantowaną fosforanem glinu i prezentowaną jako pojedyncza dawka (w szklanych strzykawkach lub szklanych fiolkach) lub dwie dawki (w szklanych fiolkach), gotowa do wstrzyknięcia domięśniowego. Objętość na dawkę nominalną wynosi 0,5 ml.
Czynnik aktywny
10 aktywnych składników zawartych w Synflorix składa się z serotypów polisacharydów Streptococcus pneumoniae 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F i 23F, każdy skoniugowany z białkiem wektorowym (PD, TT lub DT). Oczyszczone polisacharydy, toksoid tężcowy, toksoid błoniczy i białko D są uważane za półprodukt .
Produkcja
Proces produkcji skoniugowanych czynników obejmuje następujące główne fazy:
1.Fermentacja szczepów bakteryjnych S. pneumoniae, a następnie inaktywacja i oczyszczenie polisacharydów (PS),
2. Fermentacja E. coli do produkcji rekombinowanego białka D (PD), a następnie oczyszczenie PD,
3.Fermentacja Clostridium tetani do produkcji toksyny tężcowej (TT), a następnie detoksykacja i oczyszczanie TT,
4.Fermentacja Corynebacterium diphtheriae do produkcji toksoidu błoniczego (DT), a następnie detoksykacja i oczyszczanie DT ,
5. Wytwarzanie koniugatów: sprzęganie każdego z polisacharydów serotypu S. pneumoniae z PD, DT lub TT przy użyciu CDAP (tetrafluoroboran 1-cyjano-4-dimetyloamino-pirydyniowy) jako odczynnika chemicznego.
6. Sterylizacja i filtracja koniugatów.
WYNIKI Analizy LC-MS
Synflorix, nr serii:
– ASPNB201CA
– ASPNB005AE
TEST ZGODNOŚCI z informacjami zawartymi w ulotce produktu.
Frakcja białkowa
Analiza jakościowa (metoda Bradforda)
na podstawie wbudowanej linii kalibracyjnej wykryto stężenie białka niższe niż 0,25 mg / ml.
Z przeglądu literatury na temat białek zidentyfikowanych przez MS-BLAST wyłoniły się dwa możliwe białka,
potencjalnie szkodliwe dla ludzi (Tabela 1).
Poszukiwania toksyny i zanieczyszczenia

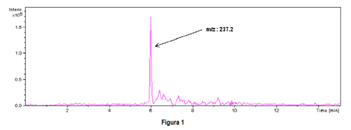
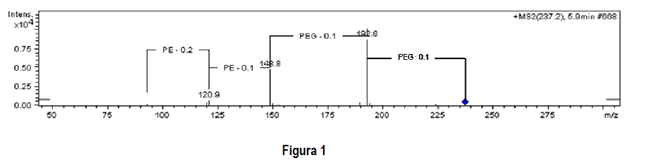
Jon o stosunku m / z 237,2 dał pik o wysokiej intensywności (tabela 1 powyżej) w partii ASPNB005AE. W partii ASPNB201CA jon występuje, ale z mniejszą intensywnością.
Po analizach przeprowadzonych na próbce z serią ASPNB005AE możliwe było uzyskanie widma fragmentacji jonów 237,2. Na podstawie strat neutralnych (ryc. 1) możemy postawić hipotezę o podobieństwie cząsteczki do rodziny molekularnej glikolu polietylenowego (PEG)
WYNIKI ANALIZY W NGS
Nie było możliwe znalezienie i identyfikacja, za pomocą metody głębokiego sekwencjonowania, wirusowego materiału genetycznego lub jakiegokolwiek innego źródła w seriach Synflorix ASPNB005AE i ASPNB201CA
DYSKUSJA WYNIKÓW
Przeprowadzona analiza to przegląd składu szczepionki w próbce gotowej do użycia, przeprowadzony w celu zweryfikowania zgodności z danymi zawartymi charakterystyce produktu leczniczego oraz możliwej obecności niewpisanych zanieczyszczeń, które mogłyby spowodować, że preparat jest ?wadliwy? z punktu widzenia jakości i potencjalnie niebezpieczny dla zdrowia.
Z analizy wynika, że:
- nie było możliwe zidentyfikowanie aktywnych składników szczepionki, tj. 10 skoniugowanych antygenów szczepionkowych.
- stwierdzono obecność nierozpuszczalnego i niestrawnego agregatu (zwanego ?makrocząsteczką?).
- w badaniu ilościowym za pomocą testu Bradforda stężenie białka wynosi około 0,25 mg / ml (125 mikrogramów / dawkę), tj. jest wyższe niż suma ilości antygenów. Wynika z tego, że w szczepionce prawdopodobnie występują inne zanieczyszczenia białkowe pochodzące z procesu produkcyjnego lub z użytych surowców.
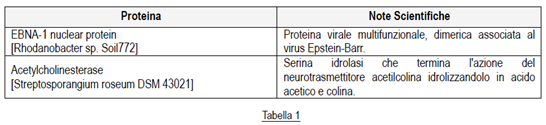
– Zidentyfikowano dwa zanieczyszczające białka:
- białko jądrowe wirusa EBNA-1
- acetylocholinoesterazy
– zanieczyszczenie chemiczne: obecność polimeru glikolu polietylenowego
– zanieczyszczenie przypadkowego materiału genetycznego: brak
Zagrożenia dla zdrowia:
- makrocząsteczka składa się z nierozpuszczalnego i niestrawnego agregatu między antygenami i adiuwantem glinowym. Może stanowić zagrożenie dla zdrowia, ponieważ może pozostać w miejscu wstrzyknięcia i stymulować przedłużoną odpowiedź zapalną, ponieważ wiązanie z glinem może uczynić antygeny szczególnie odpornymi na rozkład nawet in vivo. Z literatury wiadomo, że przedłużony stan zapalny wiąże się ze zwiększonym ryzykiem chorób autoimmunologicznych (1), a gdy przeciwciała, które powstają po szczepieniu, reagują krzyżowo z określonymi ludzkimi białkami obecnymi w mózgu, dochodzi do bardzo poważnego uszkodzenia neurologicznego2. Wykazano również, że adiuwant aluminiowy może być transportowany z miejsca wstrzyknięcia do innych części ciała przez makrofagi ze szczególnie szkodliwym działaniem, jeśli uda mu się osadzić w mózgu 3 .Ponieważ w tym przypadku aluminium wiąże się chemicznie z antygenami, można założyć, że antygeny są również transportowane i osadzane w innych miejscach wraz z aluminium z możliwymi reakcjami zapalnymi / autoimmunologicznymi.
- białko jądrowe EBNA-1 wirusa Epstein-Barr jest skażeniem niewiadomego pochodzenia. Biorąc pod uwagę jego zdolność do interakcji i modyfikacji komórkowego DNA, białko EBNA-1 bierze udział w procesie rakotwórczości zarówno linii komórkowych in vitro, jak i in vivo4 .Ponieważ białko to jest połączone z adiuwantem glinowym, który chroni go przed degradacją, można założyć, że jego działanie onkogenne może być wydłużone w czasie.
- białko acetylocholinoesterazy jest zanieczyszczeniem niewiadomego pochodzenia. W literaturze istnieją badania, które wykazują neurotoksyczność tego białka, w szczególności związek ze śmiercią neuronów (apoptozą) i neurodegeneracją w chorobie Alzheimera5 . Białko to powiązane z adiuwantem glinowym, może nasilać działanie neurotoksyczne.
- Glikol polietylenowy jest polimerem stosowanym w procesie oczyszczania DNA uzyskanym techniką rekombinacji DNA, 6 więc może to być zanieczyszczenie procesu produkcyjnego. jego toksyczność jest powiązana z właściwościami alergizującymi, a różne doniesienia z kontroli przypadków opisano w literaturze o anafilaksji 7
KONKLUZJE
- Szczepionka Synflorix wykazuje niezgodności dotyczące składu (obecność nierozpuszczalnego i niestrawnego agregatu o nieznanej toksyczności) oraz obecność dwóch potencjalnie neurotoksycznych białek i alergizującego zanieczyszczenia chemicznego (glikol polietylenowy).
- Obecność glinu z adjuwantu w razem z antygenami i zanieczyszczeniami może zwiększyć toksyczność szczepionki ze względu na jego zdolność do wywoływania reakcji autoimmunologicznych / zapalnych zarówno w miejscu wstrzyknięcia, jak i w miejscach do których może być transportowany.
- Wynika z tego, że taka szczepionka może być odpowiedzialna za działania niepożądane (NOP), szczególnie te wpływające na ośrodkowy układ nerwowy.
Referencje:
[1]J Autoimmun. 2018 Dec;95:100-123. doi: 10.1016/j.jaut.2018.10.012. Epub 2018 Oct 26.
Molecular mimicry and autoimmunity.
Rojas M1, Restrepo-Jiménez P2, Monsalve DM2, Pacheco Y2, Acosta-Ampudia Y2, Ramírez-Santana C2, Leung PSC3, Ansari AA3, Gershwin ME4, Anaya JM5.
Cell Mol Immunol. 2018 Jun;15(6):586-594. doi: 10.1038/cmi.2017.151. Epub 2018 Mar 5.
Vaccine-induced autoimmunity: the role of molecular mimicry and immune crossreaction.
Segal Y1, Shoenfeld Y2,3
[1]Front Immunol. 2018 Apr 16;9:772. doi: 10.3389/fimmu.2018.00772. eCollection 2018.
Editorial: Neuro-Immune Interactions in Inflammation and Autoimmunity.
Terrando N1, Pavlov VA2.
Annu Rev Immunol. 2018 Apr 26;36:783-812. doi: 10.1146/annurev-immunol-042617-053158.
Molecular and Functional Neuroscience in Immunity.
Pavlov VA1, Chavan SS1, Tracey KJ1.
[1]Autoimmun Rev. 2019 Jul;18(7):691-705. doi: 10.1016/j.autrev.2019.05.006. Epub 2019 May 4.
Myalgia and chronic fatigue syndrome following immunization: macrophagic myofasciitis and animal studies support linkage to aluminum adjuvant persistency and diffusion in the immune system.
Gherardi RK1, Crépeaux G2, Authier FJ3.
[1]Proc Natl Acad Sci U S A. 2009 Feb 17;106(7):2091-2. doi: 10.1073/pnas.0812575106. Epub 2009 Feb 11.
Is the Epstein-Barr virus EBNA-1 protein an oncogen?
Proc Natl Acad Sci U S A. 2009 Feb 17;106(7):2313-8. doi: 10.1073/pnas.0810619106. Epub 2009 Jan 12.
The Epstein-Barr virus nuclear antigen-1 promotes genomic instability via induction of reactive oxygen species.
Gruhne B1, Sompallae R, Marescotti D, Kamranvar SA, Gastaldello S, Masucci MG.
Leukemia. 2011 Jun;25(6):1017-25. doi: 10.1038/leu.2011.35. Epub 2011 Mar 11.
The Epstein-Barr virus nuclear antigen-1 promotes telomere dysfunction via inductionof oxidative stress.
Curr Top Microbiol Immunol. 2015;391:3-34. doi: 10.1007/978-3-319-22834-1_1.
EBNA1.
Viruses. 2012 Sep;4(9):1537-47. doi: 10.3390/v4091537. Epub 2012 Sep 13.
Contributions of Epstein-Barr nuclear antigen 1 (EBNA1) to cell immortalization and survival.
[1]Mol Psychiatry. 1998 May;3(3):247-55.
Toxic effects of acetylcholinesterase on neuronal and glial-like cells in vitro.
Calderón FH1, von Bernhardi R, De Ferrari G, Luza S, Aldunate R, Inestrosa NC.
ChemBiol Interact. 2013 May 25;203(3):543-6. doi: 10.1016/j.cbi.2013.03.015. Epub 2013 Apr 3.
Discovering and targeting the basic mechanism of neurodegeneration: the role of peptides from the C-terminus of acetylcholinesterase: non-hydrolytic effects of ache: the actions of peptides derived from the C-terminal and their relevance to neurodegeneration.
Protein Pept Lett. 2012 Feb;19(2):165-72.
From protein to peptides: a spectrum of non-hydrolytic functions of acetylcholinesterase.
Front MolNeurosci. 2012 Apr 10;5:40. doi: 10.3389/fnmol.2012.00040. eCollection 2012.
Acetylcholinesterase involvement in apoptosis.
PostepyBiochem. 2005;51(2):154-61.
[Acetylcholinesterase–apoptosis induction, role in neurological diseases and leukemia].
[Article in Polish]
[1]https://pdfs.semanticscholar.org/477c/dab32aec4b0cef3a0fd71e3253aa38fd9c22.pdf
[1]J Allergy Clin Immunol Pract. 2019 Jul – Aug;7(6):1874-1875. doi: 10.1016/j.jaip.2019.05.001.
Polyethylene Glycol Is a Cause of IgE-Mediated Anaphylaxis.
Allergy Asthma Clin Immunol. 2016 Dec 13;12:67. doi: 10.1186/s13223-016-0172-7. eCollection 2016.
Polyethylene glycol as a cause of anaphylaxis.
Allergy Asthma Clin Immunol. 2019 Feb 19;15:9. doi: 10.1186/s13223-019-0327-4. eCollection 2019.
Immediate hypersensitivity to polyethylene glycols in unrelated products: when standardization in the nomenclature of the components of drugs, cosmetics, and food becomes necessary.
JoverCerdá V1, Rodríguez Pacheco R1, DoménechWitek J1, Marco de la Calle FM2, de la Sen Fernández ML2.
ClinExp Allergy. 2016 Jul;46(7):907-22. doi: 10.1111/cea.12760.
Immediate-type hypersensitivity to polyethylene glycols: a review.
Intest Res. 2015 Jan;13(1):90-4. doi: 10.5217/ir.2015.13.1.90. Epub 2015 Jan 29.
Anaphylactic shock caused by ingestion of polyethylene glycol.
Lee SH1, Cha JM1, Lee JI1, Joo KR1, Shin HP1, Baek IH1, Jeon JW1, Lim JU1, Lee JL1, Lee HM1, Cho YH1.
CAN YOU REALLY BE ALLERGIC TO AN ?INACTIVE? INGREDIENT?